近期,江南大学生命科学与健康工程学院邹亮华课题组设计和开发了一种通过金属及光催化剂选择性C−C键裂解实现对映选择性远程烷基化的新方法,研究成果以“Enantioselective Remote Alkylation Enabled by Metallaphotoredox Catalysis via Selective C−C Bond Cleavage”为题在《ACS Catalysis》上发表。论文第一单位为江南大学生命科学与健康工程学院,第一作者为该单位22级硕士研究生敖宇,通讯作者为该单位邹亮华副教授和上海科技大学黄焕明研究员。
近年来,开发高效简洁的策略用于构建结构多样性和复杂性的有用分子一直是有机合成领域的研究热点。邹亮华课题组一直致力于杂环化合物的绿色合成和应用研究,基于一些杂环化合物具有良好的反应位点和一些合成子的特殊反应活性(包括1,3-二酮、苯乙醛、硫叶立德、烯胺酮和铵盐等),该课题组采用开环重组的策略,开发了一系列杂环化合物(比如喹啉、吲哚和喹唑啉酮等)的合成方法,相关的研究成果发表在国际重要学术期刊上(Org. Chem. Front.2018,5, 3464;Eur. J. Org. Chem.2019, 7725;J. Org. Chem.2019,84, 12301;Chinese Chem. Lett.2020,31, 1911;Org. Lett.2020,22, 1504;Catalysts,2023,13, 778;Eur. J. Org. Chem.2024,27, e202400359;J. Org. Chem.2024,89, 7446;Green Chem.2024,26, 9295)。
催化不对称合成在有机合成领域熠熠生辉,2001年化学诺贝尔奖授予了三位在手性催化合成领域做出杰出贡献的科学家(美国化学家诺尔斯博士和日本化学家野佐良治教授以及美国化学家沙普利斯教授)。在此,邹亮华课题组首次开发了一种非张力环醇开环不对称合成手性烯丙醇的策略。通过光氧化还原介导的质子偶联电子转移和手性铬催化,激活非张力环醇用于远端和位点特异性酮烯丙烷基化,成功实现了双手性中心的远端和位点特异性酮烯丙醇的不对称合成。这种新开发的双催化体系具有广泛的适用性,在温和的条件下进行,操作简单,并显示出对不同官能团极好的耐受性(如图1和图2),其策略也被应用于具有高对映选择性的复杂药物和天然产物衍生物的后期修饰。最后,通过机理研究提出了一种可能的反应机理(如图3)。可以预计,这种双手性催化平台将成为合成化学、药物发现和材料科学方面的一种很有价值的合成方法。
文章链接:https://doi.org/10.1021/acscatal.4c07460
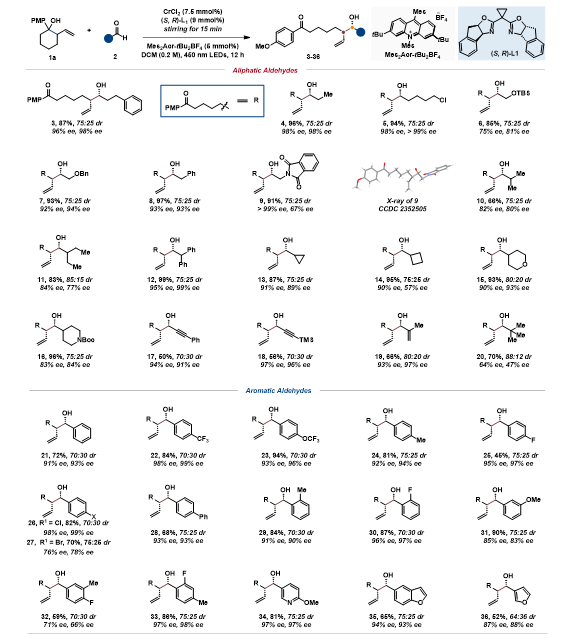
图1:底物范围一

图2:底物范围二
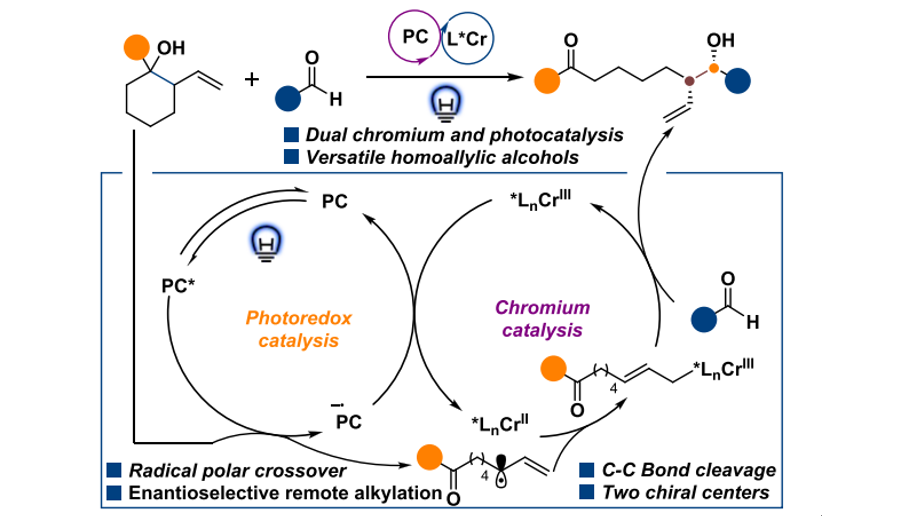
图3:反应机理


