近日,江南大学生命科学与健康工程学院赖增伟课题组与海南大学药学院黄玲/饶勇教授团队合作,在有机化学领域国际权威期刊《Organic Letters》上发表了题为"[2 + 3] Cycloaddition of para-Quinamines and para-Quinols with C,N-Cyclic Azomethine Imines: Access to 6/5/6/6-Fused Tetracyclic Pyrazolidines"的研究论文。本研究开发了一种无催化剂参与的绿色合成方法,成功构建了具有药物开发潜力的新型6/5/6/6-四环吡唑烷类杂环化合物,并发现其具有显著的抗神经炎症活性。江南大学硕士生刘哲(2023级)和丁颜(2023级)为共同第一作者,赖增伟研究员和饶勇研究员为共同通讯作者。
新药研发具有难度大、周期长的特点,而新分子实体(NMEs)结构多样性不足已成为药物开发的关键瓶颈之一。目前,现有化合物库中结构相似的分子占比过高,具有新颖骨架的化合物严重匮乏,难以满足现代药物筛选的高效需求。值得注意的是,含氮杂环作为药物化学中的优势骨架,在近十年获批的小分子药物中占比高达82%。然而,杂环结构的创新不足仍是新药研发中的核心科学问题之一。针对这一挑战,本研究开发了一种高效环化反应策略,利用4-氨基/羟基环己二烯酮与偶氮次甲基亚胺的精准转化,成功构建了结构新颖的四环吡唑烷类杂环化合物,显著拓展了杂环骨架的多样性。尤为突出的是,该方法合成的四环吡唑烷骨架可通过一步衍生化反应,进一步转化为结构复杂的类天然产物笼状杂环(含六个环及七个连续手性中心),充分展现了其在药物化学中的广阔应用前景。
在生物活性评价方面,本研究采用LPS诱导的小胶质细胞炎症模型,发现代表性化合物8表现出显著的抗炎活性。该化合物对NO释放的抑制效果尤为突出(EC50= 0.27 µM),其活性显著优于临床对照药物地塞米松。进一步研究表明,化合物8能够以剂量依赖的方式下调关键炎症因子(iNOS、COX-2、TNF-α和IL-6)的表达水平,提示其可能通过多靶点协同作用发挥抗炎效应。基于上述发现,后续研究将聚焦于:通过结构优化进一步提升其活性和成药性;在动物模型中系统评价其药效及作用机制。总之,本工作不仅拓展了杂环化合物的结构多样性和合成方法学,更为抗炎药物的研发提供了具有开发潜力的新颖先导化合物。
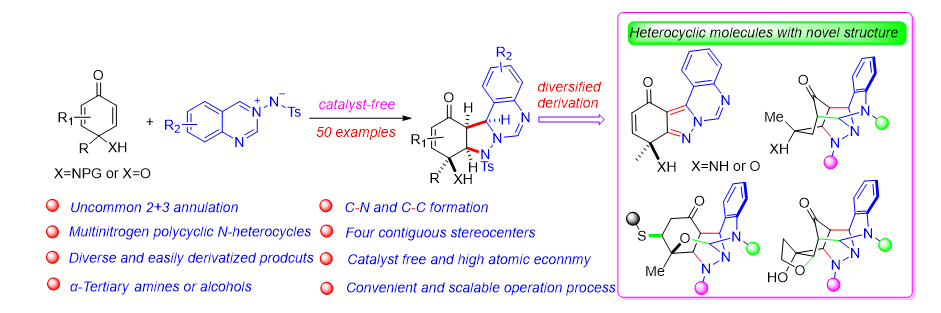
图1.图文摘要
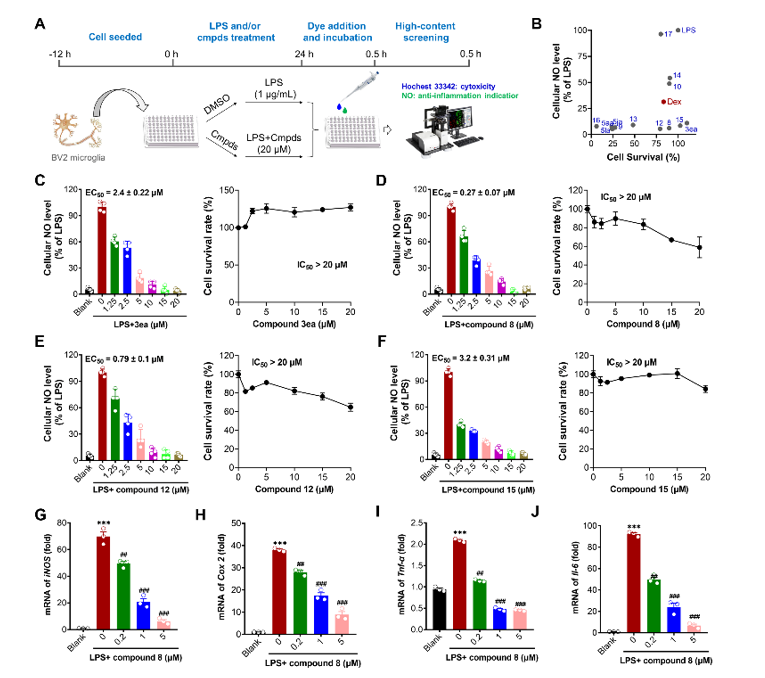
图2.抗神经炎症活性
文章链接:https://pubs.acs.org/doi/10.1021/acs.orglett.5c01087


