在合成生物学与生物催化领域,如何让蛋白质具备自然界不存在的全新催化活性并执行非天然化学反应,是科学家长期追求的目标。将携带特殊官能团的非经典氨基酸引入蛋白质是实现人工酶设计的重要策略,但传统方法通常依赖化学合成后外源添加非经典氨基酸,这种方式成本高,细胞利用效率低,并受到膜通透性和潜在毒性的限制。如何让细胞自身合成并利用非经典氨基酸,从而在体内完成人工酶的装配,是长期悬而未解的难题。

江南大学生科院周志教授联合中科院天工所近期在知名高水平学术期刊Nature Communications上发表了题为“Design and evolution of artificial enzyme with in-situ biosynthesized non-canonical amino acid”的研究论文,提出了一种将非经典氨基酸细胞内生物合成与遗传编码整合的策略,建立了一体化的人工酶设计平台,并实现了高效的不对称催化。该方法不仅提高了酶的产量和选择性,还为未来人工酶的大规模应用奠定了基础。
本研究通过整合非天然氨基酸的生物合成与遗传编码体系,在细胞内原位合成并引入具有催化功能的巯基苯胺类非天然氨基酸,从而在蛋白质骨架中一锅法构建了一类新型人工傅-克烷基化酶(SFC)。在结合理性设计与定向进化的过程中,所得优势突变体在一例非天然不对称Friedel–Crafts烷基化反应中表现出卓越性能,产物对映选择性高达95% e.e.,产率最高可达98%。本研究建立了一种通用策略,能够利用细胞内生物合成获得的多样化非天然氨基酸高效引入外源性催化基团,实现人工酶的精准设计与构建。该方法不仅显著扩展了生物催化剂在非天然反应中的应用边界,也为人工酶学科的发展提供了新的工具与理论支撑。
通过将非天然催化中心引入蛋白口袋是设计人工酶最直接的策略之一。遗传密码子扩展技术为蛋白质结构和功能的修饰提供了强大的技术支持,同样为创制具有非天然催化功能的人工酶提供了机会。目前,已有超过300种非天然氨基酸通过遗传密码子扩展技术被掺入蛋白中,但绝大多数需外源添加,而且通常价格高昂、合成难度大。开发能够整合进宿主细胞代谢的非天然氨基酸生物合成路径,并结合遗传密码子扩展技术,可显著拓展含非天然氨基酸人工酶用于生物催化的应用范围。这一策略对于人工设计酶的定向进化,以及将其整合至现有生物合成路径以构建混合代谢通路而言,更是一个极具吸引力的研究方向(图1)。
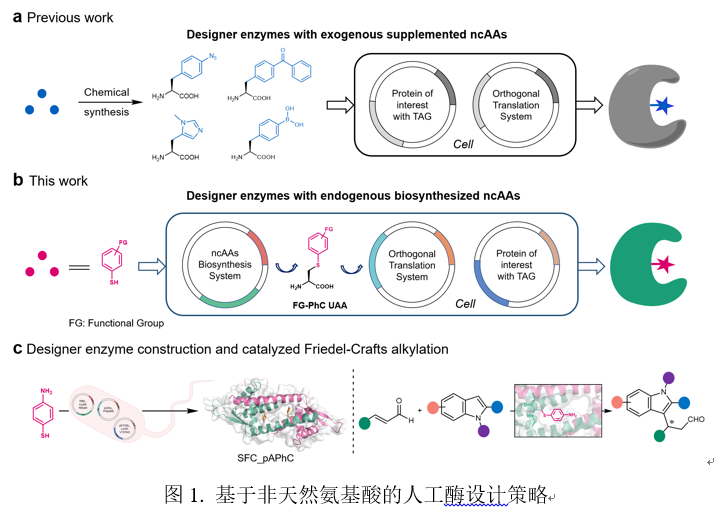
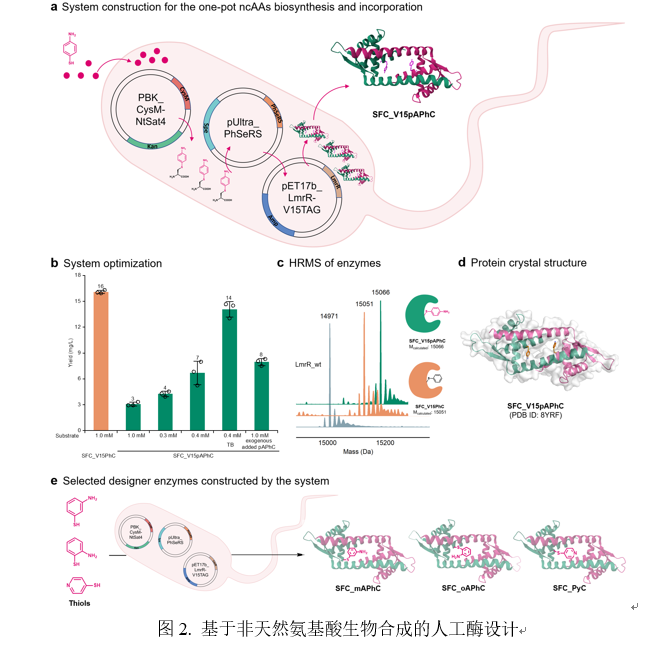
本研究通过整合S-芳香基半胱氨酸生物合成系统、兼容的正交翻译系统和目标蛋白质表达系统,创建了用于原位生物合成非天然氨基酸的人工酶。作者通过将三个质粒(分别编码工程化CysM、OTS和LmrR整合到大肠杆菌中,构建了人工酶表达系统。作者只需在培养基中添加ncAA前体底物,细胞工厂便可自动产生含有pAPhC残基的人工酶SFC_pAPhC。通过进一步优化细胞生长条件(如培养基、温度和前体浓度),SFC_V15pAPhC的表达水平提升至14 mg/L。为验证该系统的兼容性,作者成功构建了含非天然mAPhC、oAPhC和PyC的多种含硫醇类ncAA人工酶。这些结果表明,该体系提供了一种高效便捷的人工酶设计策略,并在建立多样化人工酶库方面展现出巨大潜力(图2)。
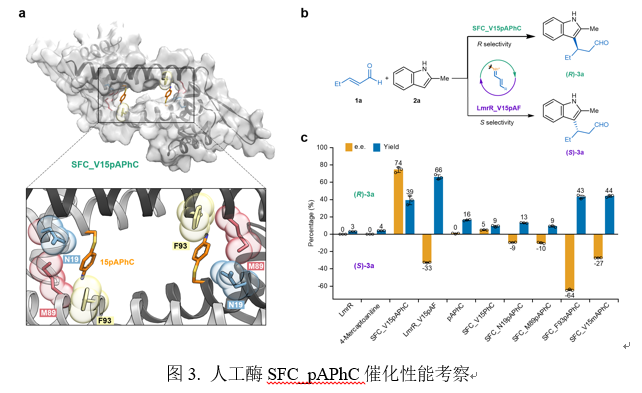
为了验证SFC_pAPhC的催化活性,作者选择通过亚胺催化机制研究吲哚与不饱和醛的不对称Friedel-Crafts烷基化反应。SFC_V15pAPhC催化1 mM 2-甲基吲哚和5 mM反式-2-戊烯醛,获得74%对映异构体过量值(e.e.)和39%产率,其构型为R型。值得注意的是,与先前报道的人工酶LmrR_pAF相比,本研究设计的SFC_V15pAPhC在催化同样的反应中表现出相反的对映选择性,这些结果表明硫原子的引入导致SFC_V15pAPhC与LmrR_V15pAF在反应活性和立体选择性方面产生显著差异(图3)。
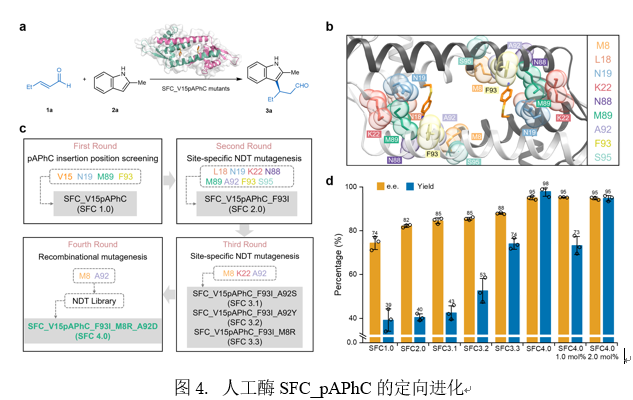
基于SFC_V15pAPhC所展现出的良好对映选择性和活性,作者采用了迭代定点突变策略来优化人工酶。通过晶体结构指导(PDB: 8YRF),首先采用丙氨酸扫描法系统评估了催化位点周边残基在Friedel-Crafts反应中的催化作用。经过三轮组合突变进化与反应参数优化,最终获得最优突变体SFC4.0(SFC_V15pAPhC_IRD),其对映选择性达95% e.e.,产率达98%。动力学分析表明,进化后的SFC4.0突变体催化效率达0.64 ± 0.22 M⁻¹ s⁻¹,较SFC1.0(0.12 ± 0.04 M⁻¹ s⁻¹)提升5.5倍,证实定向进化策略显著增强了酶催化性能(图4)。
本研究的意义不仅在于获得了一种高效人工酶,更在于提出了一种通用的集成策略。通过将代谢工程与遗传密码子扩展相结合,研究人员建立了一个能够灵活引入多种非经典氨基酸并进行定向进化的细胞工厂平台。利用这一平台,只需更换不同的前体分子,即可快速构建含有多种官能团的人工酶库,从而拓展了人工酶的应用潜力。这一策略为催化新型非天然反应、开发绿色合成路径提供了可能,也为未来直接利用简单原料在细胞内构建杂合代谢通路奠定了基础。随着这一平台的推广,未来有望实现更多具有复杂化学功能的人工酶,为绿色化工、药物合成和可持续能源等领域提供关键工具。
本论文的第一作者分别为江南大学2021级硕士研究生黄薇、天津工生所王世平博士,通讯作者为江南大学周志教授、天津工业生物技术研究所盛翔研究员。本研究得到国家重点研发计划、国家自然科学基金、江苏省自然科学基金等项目的支持。
原文链接:https://doi.org/10.1038/s41467-025-63733-3
Design and evolution of artificial enzyme with in-situ biosynthesized non-canonical amino acid
Wei Huang, Shiping Wang, Ya Wei, Yuting Bai, Zhixi Zhu, Dejing Yin, Tao Liu, Xiang Sheng & Zhi Zhou
Nat. Commun.,2025, DOI: 10.1038/s41467-025-63733-3
周志教授:江南大学教授、博导,主要从事新酶创制与催化研究。目前已在Nat. Chem., Nat. Catal., Nat. Commun., Angew. Chem., ACS Catal.等杂志发表一作/通讯论文多篇。欢迎有志于生物催化的同学报考课题组博士和硕士研究生,详见课题组主页:https://www.x-mol.com/groups/zhouzhi。


