糖原是动物的主要D-葡萄糖储存多糖,其主要由重复的葡萄糖单元通过α-D-(1-6)和α-D-(1-4)糖苷键连接形成超支化纳米球,直径约在100 nm左右。糖原纳米球表面丰富的羟基赋予其良好的水溶性、高效的嫁接性及易于修饰的特性。糖原的分子量约为10 MDa,远高于肾脏直接消除的分子量阈值(45kDa),表现出长循环特性。
基于此,陈敬华教授、周娟副研究员团队将糖原打造为对肝肿瘤主动靶向并在肿瘤部位pH响应释药的智能纳米载体。糖原通过氧化产生醛基并通过席夫碱反应与阿霉素结合,席夫碱键具有良好的pH响应效应,从而形成pH响应的药物释放模型。为了提高肝靶向效率,将糖原与半乳糖衍生物接枝,半乳糖衍生物对肝细胞上的去唾液酸糖蛋白受体(ASGPR)表现出高敏感性和特异性。动物实验显示纳米载体可在肿瘤部位积聚并有效抑制肿瘤的增长,表现出良好的抗癌作用,证实生物来源的糖原纳米颗粒作为载体在肝肿瘤治疗中具有潜在应用。研究成果发表于《Applied Materials Today》,药学院硕士研究生韩玉宁为论文第一作者,周娟副研究员、陈敬华教授为共同通讯作者。
论文链接:https://www.sciencedirect.com/science/article/pii/S2352940719306419
在以上工作基础上该团队建立了基于糖原纳米粒子的化疗-热疗肿瘤联合治疗系统。该系统通过二硫键嫁接抗肿瘤药物阿霉素,同时原位聚合具有良好生物相容性及良好光热效应的聚吡咯纳米粒子,最后所得体系被自组装的磷脂层包裹。该磷脂层可以有效保护纳米粒子免受蛋白吸附,同时磷脂层中的RGD配体与肿瘤血管内皮细胞表面高度表达的αvβ3特异结合,进而带领粒子穿透肿瘤组织并靶向肿瘤细胞。在癌细胞中高浓度的谷胱甘肽还原作用下,糖原粒子表面的二硫键被切断并释放药物,引起细胞凋亡。同时,聚吡咯纳米粒子经近红外光照射导致温度升高,促进肿瘤细胞的死亡。研究成果发表于《ACS Applied Materials & Interfaces》,周娟副研究员为论文第一作者,陈敬华教授为通讯作者。
论文链接:https://pubs.acs.org/doi/pdf/10.1021/acsami.0c02785
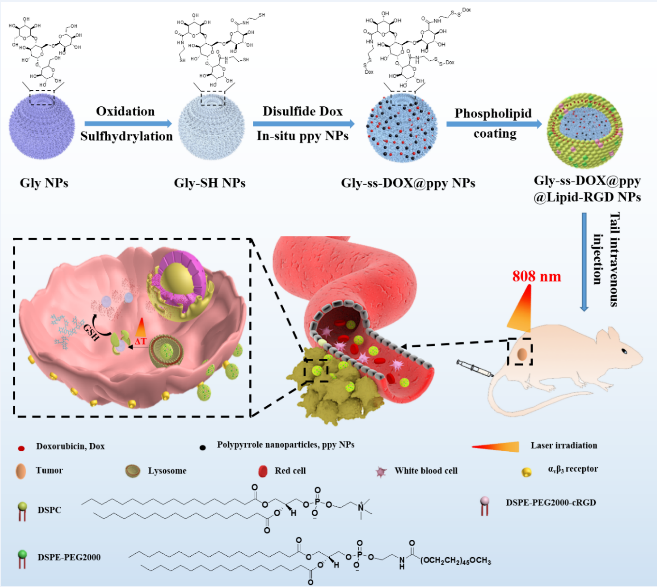
脂质体修饰化糖原纳米粒用于肿瘤化疗-光热协同治疗
上述研究得到了国家自然科学基金(21574059),江苏省自然科学青年基金(BK20170203)、中央高校基本科研基金(JUSRP51709A)和国家轻工技术与工程一流学科计划(LITE2018-20)的资助。
(文/图:周娟;审核:陈敬华)


