在国家重点研发计划(2021YFC2103100)、国家自然科学基金(22008090)等项目资助下,江南大学生命科学与健康工程学院陈敬华教授/张燕研究员团队在肿瘤免疫治疗领域取得了突破。研究成果以“Cancer vaccine designed from homologous ferritin-based fusion protein with enhanced DC-T cell crosstalk for durable adaptive immunity against tumors”为题于2025年1月在Bioactive Materials期刊上发表。该研究提出了一种创新的基于人铁蛋白轻链的纳米疫苗平台,成功实现了抗原和免疫调节siRNA的共递送,显著提升了肿瘤免疫反应。江南大学博士研究生吴君为第一作者,陈敬华教授、张燕研究员为通讯作者。
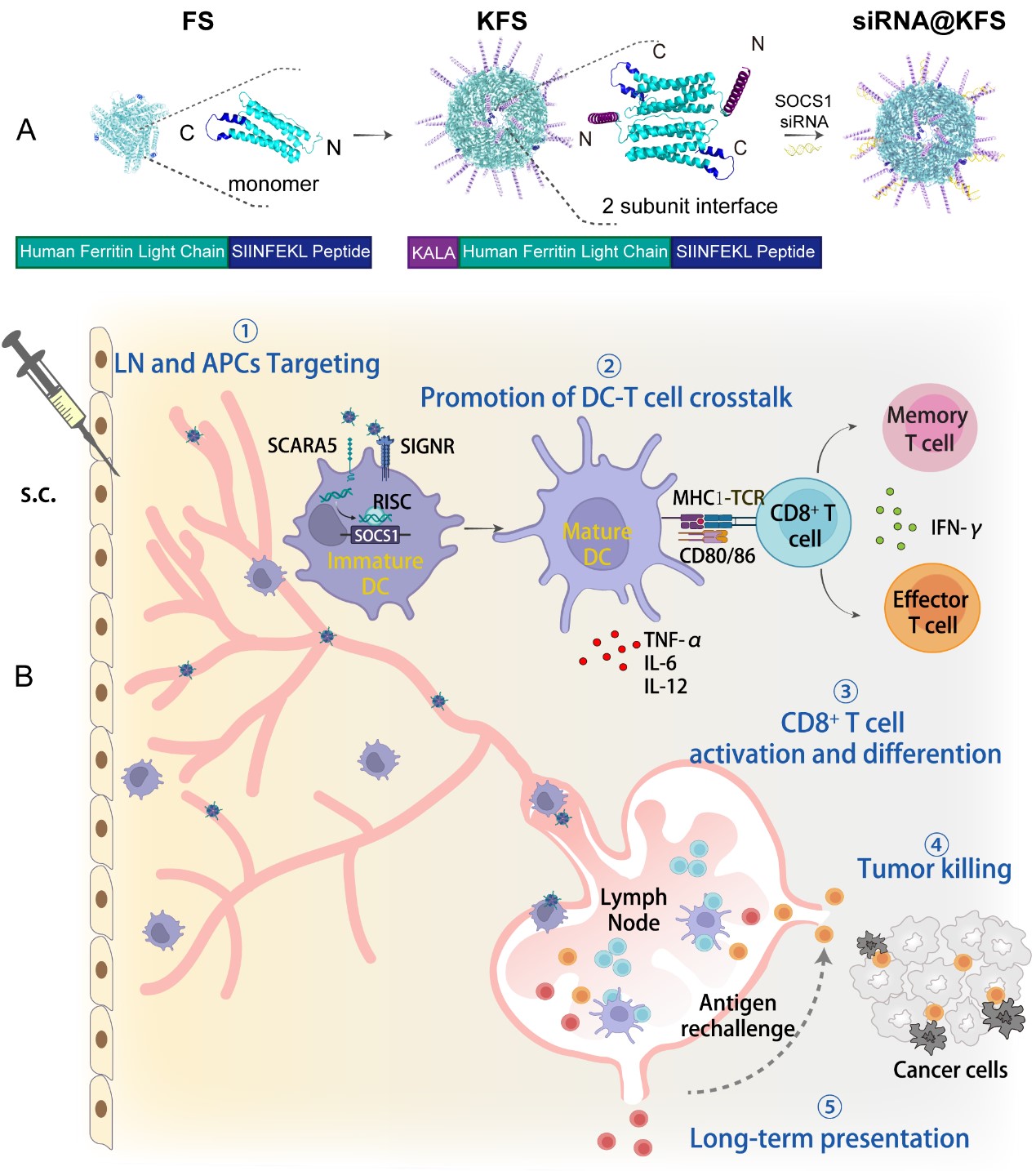
近年来,肿瘤多肽疫苗因其高生物安全性和良好耐受性而备受关注,但其低免疫原性的问题显著限制了其临床应用。然而,目前使用外源性或促炎性物质作为佐剂或载体的解决方案可能导致先天免疫与适应性免疫循环的不平衡,从而降低适应性免疫的效能。为解决这些问题,研究团队开发了基于同源铁蛋白的多功能纳米疫苗,以避免过度激活先天免疫所带来的不良影响;同时,通过调节免疫抑制微环境诱导高效的肿瘤免疫治疗,激发对肿瘤的持续保护效力。
(1)将人铁蛋白轻链与KALA肽以及可替换的肿瘤新抗原相融合,形成了粒径约25 nm的40聚蛋白纳米笼,不仅提高了抗原的密度,增强了树突状细胞(DC)对抗原的识别和摄取效率,还促进了淋巴结引流,提升了疫苗的靶向递送能力。(2)通过KALA肽协同递送SOCS1 siRNA,成功恢复了DC的JAK/STAT通路,解除了肿瘤微环境中的免疫抑制,显著提高了树突细胞的成熟度,并增强了CD8+ T细胞的活性和免疫应答。(3)在肿瘤治疗中,该纳米疫苗在肿瘤特异性抗原(SIINFEKL)和肿瘤相关抗原(gp100)小鼠模型中均表现出较强的抑制肿瘤生长效果,并有效延长了小鼠的生存期。(4)使用同源铁蛋白代替外源性佐剂,避免了过度激活先天免疫引起的不良反应,同时,刺激了更多记忆T细胞,并提供了近60天的持续肿瘤预防,减少接种频率。(5)通过精确设计,将抗原、免疫调节分子和靶向递送功能巧妙融合于一体,为肿瘤免疫治疗提供了全新的解决方案。研究团队将该纳米疫苗应用于高侵袭性和转移潜力的肿瘤模型(如B16F10小鼠模型),验证了其在肿瘤免疫治疗中的广泛应用潜力。
该研究中的融合蛋白纳米疫苗具备协同递送抗原和siRNA的能力,在促进树突状细胞成熟和增强T细胞活性方面效果显著,且无需添加任何佐剂,为肿瘤治疗和预防提供了一种新策略,为个性化肿瘤疫苗的设计开辟了新的途径。
文章连接:https://www.sciencedirect.com/science/article/pii/S2452199X24005668


