近期,我校生命科学与健康工程学院周志教授课题组在新型人工酶设计与创制方面取得了重要进展,在著名化学期刊Organic Letters上发表了题为“Design and Evolution of an Artificial Aldolase with an Abiological Catalytic Cofactor in Apo-Myoglobin”的研究论文。这项工作发展了一种基于肌红蛋白的人工醛缩酶设计的高效策略,并展示了将非天然辅因子与酶的定向进化相结合来实现挑战性的酮类分子参与的不对称Aldol反应。论文第一作者为江南大学生命科学与健康工程学院硕士研究生胡沁汝(2023级),通讯作者为江南大学生命科学与健康工程学院周志教授。

通过生物合成构建碳链是自然界以及实验室中合成复杂分子的基础,其中缩醛反应以其高效性而备受推崇。天然的缩醛酶在自然的进化中,通过有效残基与底物的精确定位,从而具备极高的反应速率和选择性,但却在反应类型与底物选择上具有局限性。人工缩醛酶的设计因此有望超越自然工具箱的局限性,实现以不同底物类别、在非天然位置或在非生理条件下进行的碳-碳键形成反应。通过引入催化型赖氨酸残基,研究人员从头计算设计出酶,从而实现适度的逆式醛酮反应活性,同时,后续的定向进化过程进一步提升了反应活性和立体选择性,这证实了将合理设计与实验室优化相结合的可行性。此前报道的设计或工程化的醛缩酶主要以伯胺残基为主,多活化醛类底物,而活化酮类底物的报道则相对较少。目前已报道的向蛋白中引入仲胺催化中心的策略包括将非天然氨基酸通过基因整合的方式引入,以及使用链霉菌素-生物素结合技术,这些策略被应用于实现对酮的不对称缩醛反应,但手性选择较为一般。
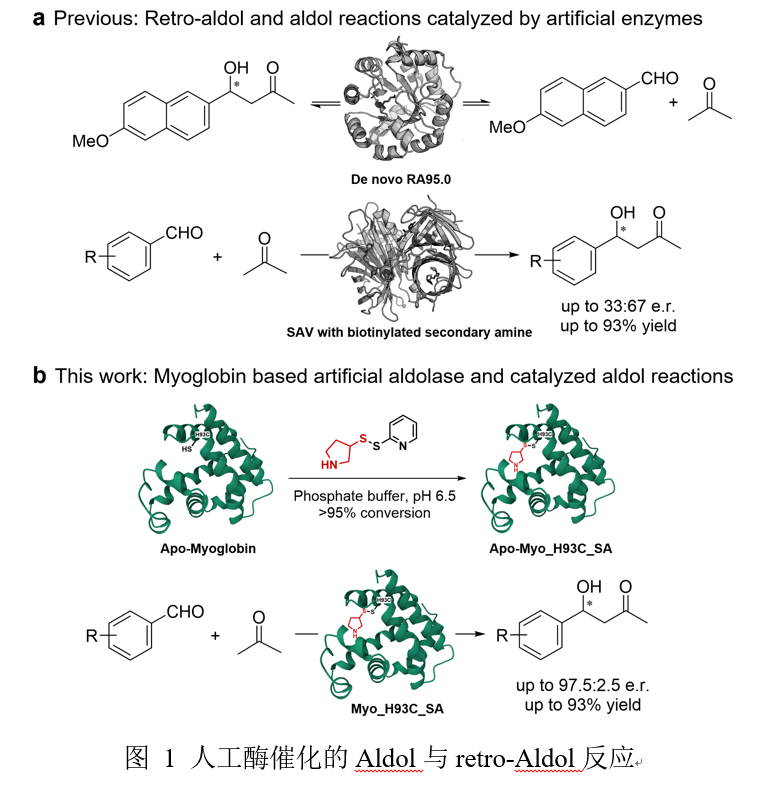
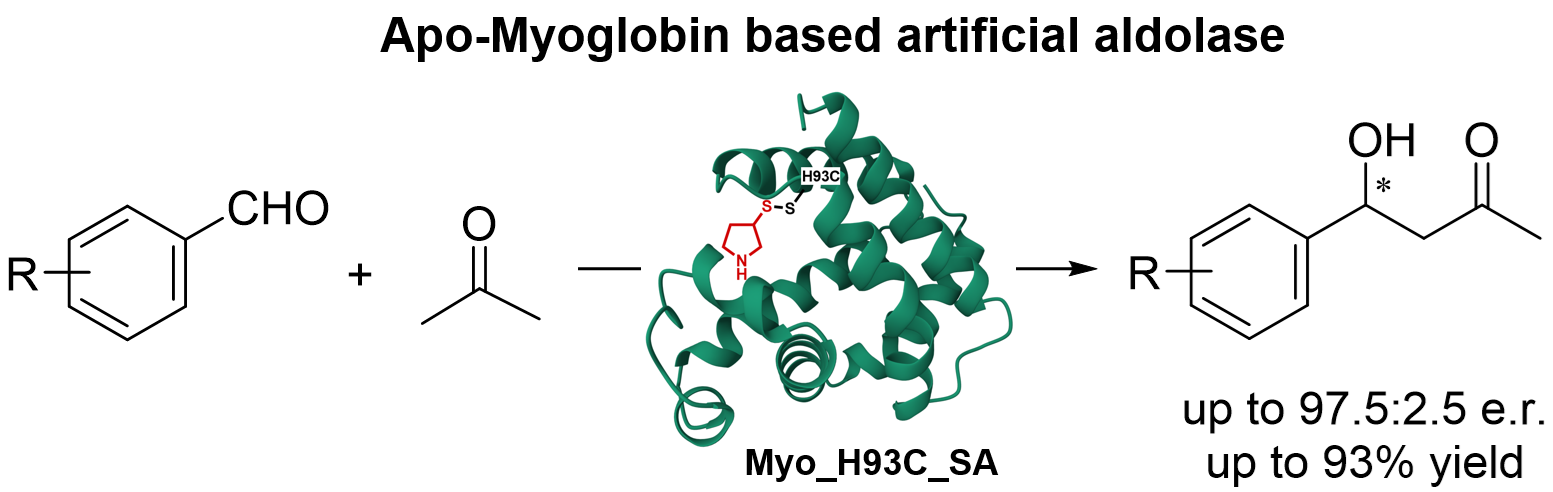
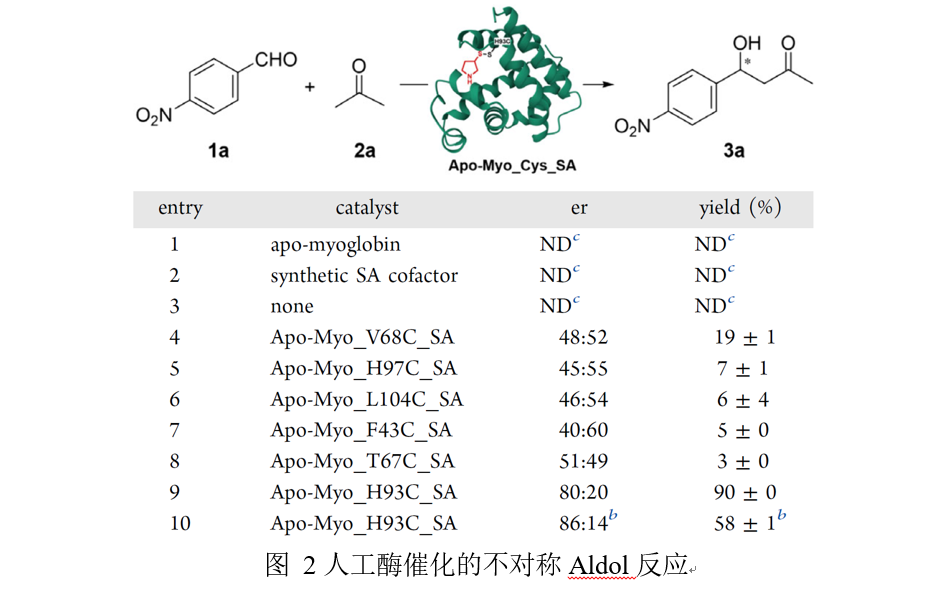
本研究中使用的肌红蛋白是一种由a螺旋血红素构成的小分子蛋白质,已被证明是一种极具多功能性的结构支架,可用于构建非天然活性。作者通过构建肌红蛋白变体,使其丧失天然结合血红素的能力,从而提供无辅基肌红蛋白骨架,随后在半胱氨酸残基上引入具有次级胺(SA)基团的合成辅因子构建出人工酶。基于肌红蛋白结构,作者选择了10个位置并将其突变为胱氨酸残基,以对合成的SA辅因子进行共价修饰,并且选择了丙酮与对硝基苯甲醛之间的缩醛反应作为研究的模型反应。经过筛选,有六种酶表现出可检测的对映选择性和催化活性,其中,Apo-Myo_H93C_SA显示出最高的反应活性和对映选择性,比例为80:20,产率为90%。此外,对反应条件的优化表明,降低温度和提高pH值能够提高对映选择性,其比例为86:14。
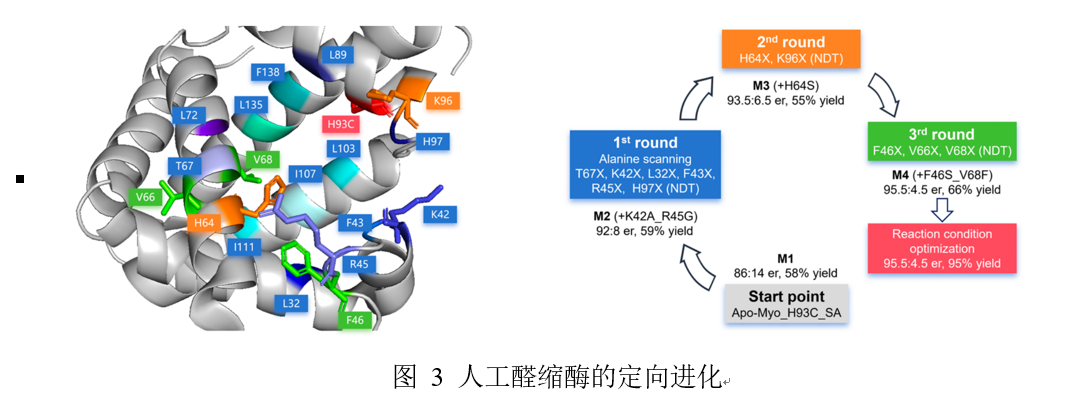
基于突变体Apo-Myo_H93C_SA所展现出的良好对映选择性和活性,我们采用了迭代式的定点定向突变策略来优化人工酶。我们根据肌红蛋白的晶体结构,通过丙氨酸扫描法研究了朝向腔体内且靠近位置93的残基,来评估他们在缩醛反应中的催化活性。后续通过分析氨基酸残基的位置以及大小,先后进行了四轮组合突变进化并优化了反应参数,并确定M4(Apo-Myo_H93C_K42A_R45G_H64S_F46S_V68F_SA)为最优突变体(其对映选择性为95.5:4.5,产率为95%)。
该研究展示了一种基于肌红蛋白的人工醛缩酶设计,通过将非天然的仲胺辅因子共价锚定在其口袋中作为酶的催化中心,从而有效催化碳-碳键的形成,构建手性羟基酮类化合物。通过策略性的半胱氨酸连接以及迭代式的定向进化,我们优化后的变体在丙酮以及多种醛类底物上均展现出出色的对映选择性。本研究不仅拓展了基于肌红蛋白的生物催化体系的应用范围,也展示了将非天然辅因子与蛋白质工程相结合以实现超越天然酶催化能力的潜力。未来的研究将聚焦于探索多种有机催化模式及替代性蛋白质支架,以推动在温和、环境友好的条件下实现酶催化非天然反应的发展。
该研究工作得到了江南大学启动经费、科技部重点研发计划、国家自然科学基金、江苏省自然科学基金等项目的支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.orglett.5c03309
教授简介
周志博士,江南大学教授、博导,江苏省特聘教授,主要从事新酶创制与催化研究。目前已在Nature Chemistry, Nature Catalysis, Angew. Chem., ACS Catalysis等杂志发表多篇一作/通讯研究论文。实验室欢迎优秀学生报考本课题组的博士和硕士研究生,详见课题组主页:https://www.x-mol.com/groups/zhouzhi


