
近日,江南大学周志教授课题组在化学期刊Organic Letters上发表了题为“Enzymatic Enantioselective Protonation Regulated by an Artiffcial Enzyme Harboring an In Situ-Biosynthesized S‑(3-Aminophenyl)-cysteine”的研究论文。该研究通过引入原位生物合成非天然氨基酸成功构建一类新型人工酶,该酶可高效催化一例非天然的傅克烷基化-不对称质子化反应。通过结合理性设计与定向进化,获得的优势突变体对该不对称质子化反应表现出较好的催化活性与对映选择性。该系统彰显了通过集合非天然氨基酸生物合成与引入的策略在新功能人工酶创制中的重要能力,为拓展人工酶催化多样性边界、实现非天然反应提供了有效的方法。
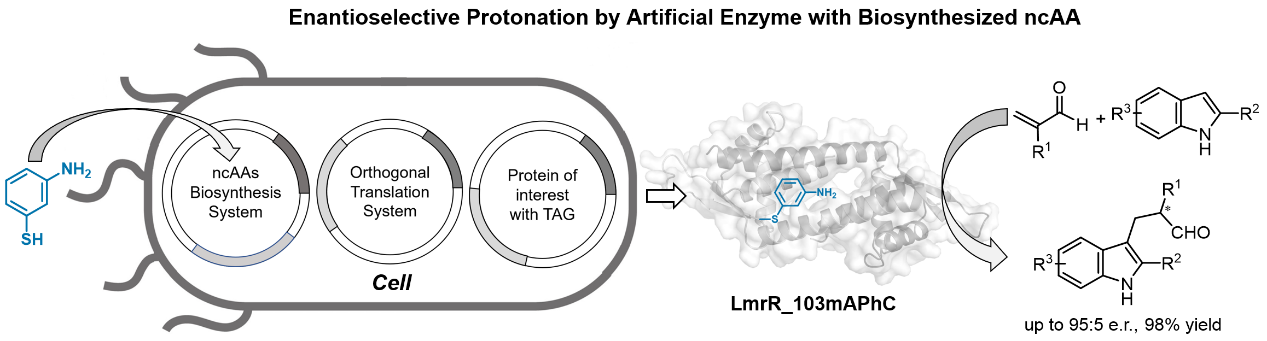
在化学合成领域,天然酶虽然以高特异性和催化效率著称,但其催化能力受限于20种标准氨基酸,难以满足复杂反应需求。而人工酶设计,正成为打破这一局限的关键策略。非天然氨基酸(ncAAs)能为酶活性位点引入新功能基团,实现天然酶无法实现的非天然反应。目前已有超300种ncAAs通过遗传密码拓展技术整合到蛋白质中,但多数ncAAs市售难、价格高,化学合成步骤复杂且纯化难度大。为此,科研团队将目光投向宿主生物体内ncAAs的原位生物合成,以大肠杆菌为载体,借助基因工程策略实现ncAAs细胞内合成,彻底摆脱对外源化学合成的依赖,为人工酶构建奠定高效、低成本基础。此次研究以mAPhC为基础,其结构与已被报道的具有催化功能的对氨基苯丙氨酸(pAF)相似,具备通过亚胺中间体激活醛底物的潜在催化优势。团队选择乳酸菌多药耐药性调节蛋白(LmrR)作为酶设计支架,该二聚体蛋白独特的疏水空腔与可进化性成为构建人工酶的理想选择。通过将编码工程化半胱氨酸合成酶(CysM)、正交翻译系统(OTS)和LmrR变体的三个质粒共转化至大肠杆菌中,在培养过程中添加前体底物间氨基苯硫酚,便可成功原位生物合成非天然氨基酸mAPhC并引入至目标蛋白中,构建出含非天然苯胺残基催化位点的新型人工酶。
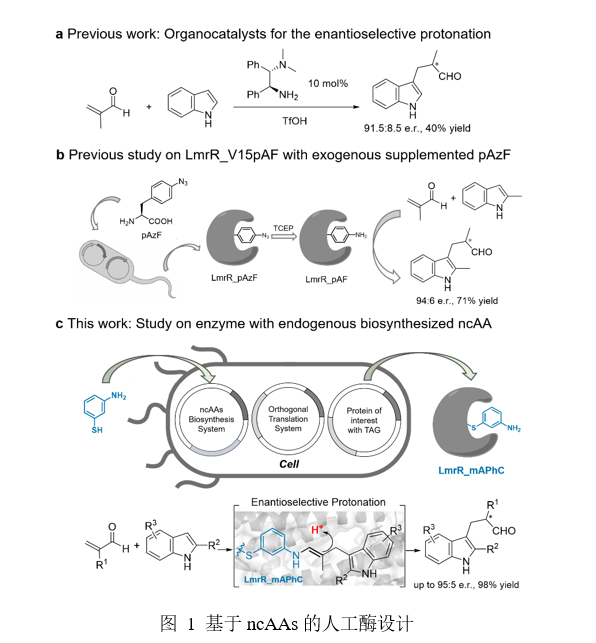
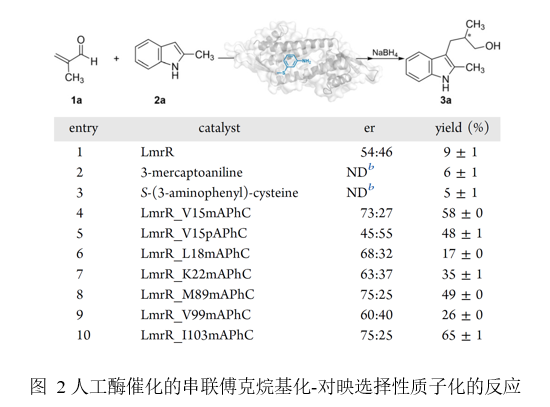
基于三质粒体系成功获得目标人工酶后,为验证人工酶的催化潜力,研究团队考察了一例具有一定挑战性的非天然不对称质子化反应。酶催化实验以人工酶LmrR_V15mAPhC为催化剂,以5 mM 2-甲基丙烯醛(1a)和1 mM 2-甲基吲哚(2a)为模型底物进行考察,初始反应获得73:27的er及58%产率。对比实验显示,无mAPhC残基的野生型酶(LmrR_WT)仅以54:46的er及9%的产率生成目标产物,mAPhC或间氨基苯硫酚作为催化剂时则无对映选择性且转化率<6%,证明了人工酶LmrR_mAPhC在此不对称质子化反应中对质子转移的重要调控作用。
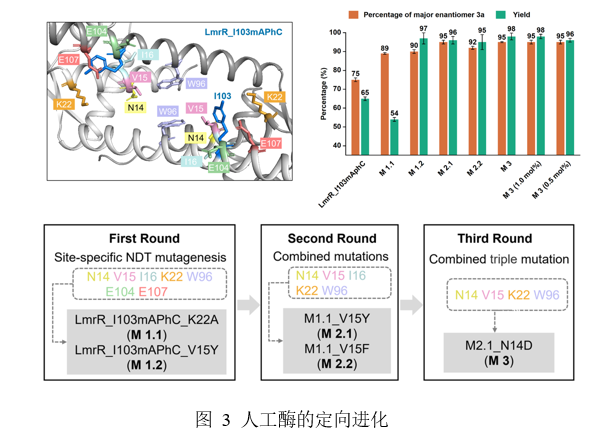
基于初步成果,团队开启定向进化以提升人工酶性能。首先筛选LmrR蛋白疏水腔内19个朝向活性位点口袋的位置,构建mAPhC突变体库,发现LmrR_I103mAPhC表现出75:25 er,65%的产率。随后通过丙氨酸扫描系统识别关键氨基酸,锁定7个关键位置(14-16、22、96、104和107),并利用NDT密码子随机生成密码子库进行突变优化。经多轮筛选与组合突变,成功获得系列高性能突变体:第一轮筛选出高选择性的LmrR_I103-mAPhC_K22A(M1.1)与LmrR_I103mAPhC_V15Y(M1.2);进一步组合得到双突变体M1.1_V15Y(M2.1),其对映选择性达95:5 er;最终通过与N14D组合,获得最优三重突变体M2.1_N14D(M3),其对映选择性高达95:5 er,产率亦有显著提升。
此研究通过将非天然氨基酸原位生物合成与遗传整合相结合,为人工酶设计提供了更直接、经济的新路径。相较于以往通过直接添加ncAAs的方法,摒弃了传统依赖外部化学合成的路径,显著简化了酶的设计流程。通过将ncAAs精准引入酶的活性位点,显著提升了酶的催化效率,并实现了质子化步骤的高对映选择性调控。本研究结果为非天然氨基酸在拓展人工酶催化多样性方面的潜力提供了有效策略,同时为开发酶催化非天然反应提供了可选择的技术路径。
相关研究结果发表于在国际期刊《Organic Letters》上。第一作者为江南大学博士研究生盛玉辉,通讯作者为江南大学周志教授。感谢北京大学刘涛教授提供的技术支持。工作得到了科技部重点研发计划、国家自然科学基金、江苏省自然科学基金等项目的支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.orglett.5c03837
周志教授课题组主页:
https://www.x-mol.com/groups/zhouzhi


