3-羟基氧化吲哚类骨架广泛存在于天然产物中,此类化合物通常表现出显著的生物活性。这些分子中C3立体中心的绝对构型对受体结合、代谢稳定性和下游生物效应有深远影响,因此3-羟基氧化吲哚化合物的立体选择合成是一个持久的合成挑战,而目前此类化合物的生物合成报道相对较少。

近日,江南大学周志教授课题组在中科院一区期刊Organic Letters上发表了题为“Directed Evolution of Artificial Aldolase for Enantioselective Biosynthesis of 3‑Hydroxy-Oxindoles”的研究论文。研究人员在肌红蛋白骨架(Myoglobin)中位点特异性地引入人工仲胺辅因子构建人工醛缩酶。该人工酶能够高效催化吲哚醌与活化酮之间的C−C键合成,经定向进化,工程化的人工醛缩酶制备获得的手性3-羟基氧化吲哚类化合物具有优异的对映选择性(最高可达96:4 er)和反应活性(最高可达99%产率)。该人工酶将化学小分子催化剂的非天然催化活性与蛋白骨架的可调性相结合,从而使得高效获取具有药用价值的手性吲哚醌成为可能。
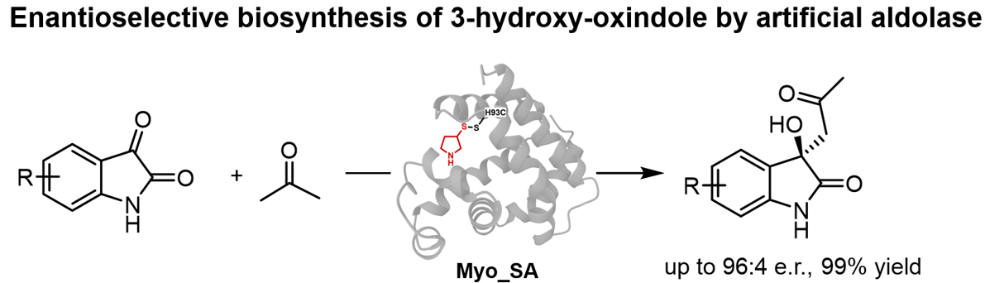
手性3-羟基氧化吲哚骨架在天然产物化学和药物化学中都占有重要地位。这一结构基元存在于多种具有生物活性的生物碱中,如Convolutamydines A、donaxaridines和Maremycins A,并支撑着多个候选药物的活性。这些分子中C3立体中心的绝对构型对受体结合、代谢稳定性和下游生物效应有深远影响。3-羟基氧化吲哚的手性合成是一个持久的合成挑战。虽然已经开发了许多有机催化和金属催化的不对称方法,但这些方法通常需要非生理条件、化学计量添加剂或复杂的配体结构,且立体选择控制中等,底物范围有限。相比之下,醛缩酶能够在温和的水相条件下催化C–C键形成,并具有精确的立体化学控制,但自然进化的酶通常只能识别有限的磷酸化或羧化底物,对非天然亲电试剂如吲哚醌类衍生物的活性有限。遗传密码扩展技术和正交共价修饰使得研究人员能够蛋白骨架中的特定位点引入非天然氨基酸或带有催化功能的人工辅因子,这些体系可实现立体选择性非天然反应。该研究设想通过设计能够结合定制催化辅因子的人工醛缩酶,可以利用蛋白质的第二配位环境进行立体诱导,将非天然亲电试剂吲哚醌类衍生物作为模式底物,实现3-羟基氧化吲哚的手性合成。
实验室前期开发了一种高效的共价策略,具有催化性的吡咯烷残基可在温和条件下通过二硫键交换对蛋白中半胱氨酸残基进行高效共价修饰。作者选择无辅基的肌红蛋白(Apo-Myo)作为蛋白骨架,该蛋白通过突变肌红蛋白中的血红素结合位点获得,并基于蛋白晶体结构选择11个氨基酸位点突变为半胱氨酸残基以进行仲胺辅因子的共价修饰。
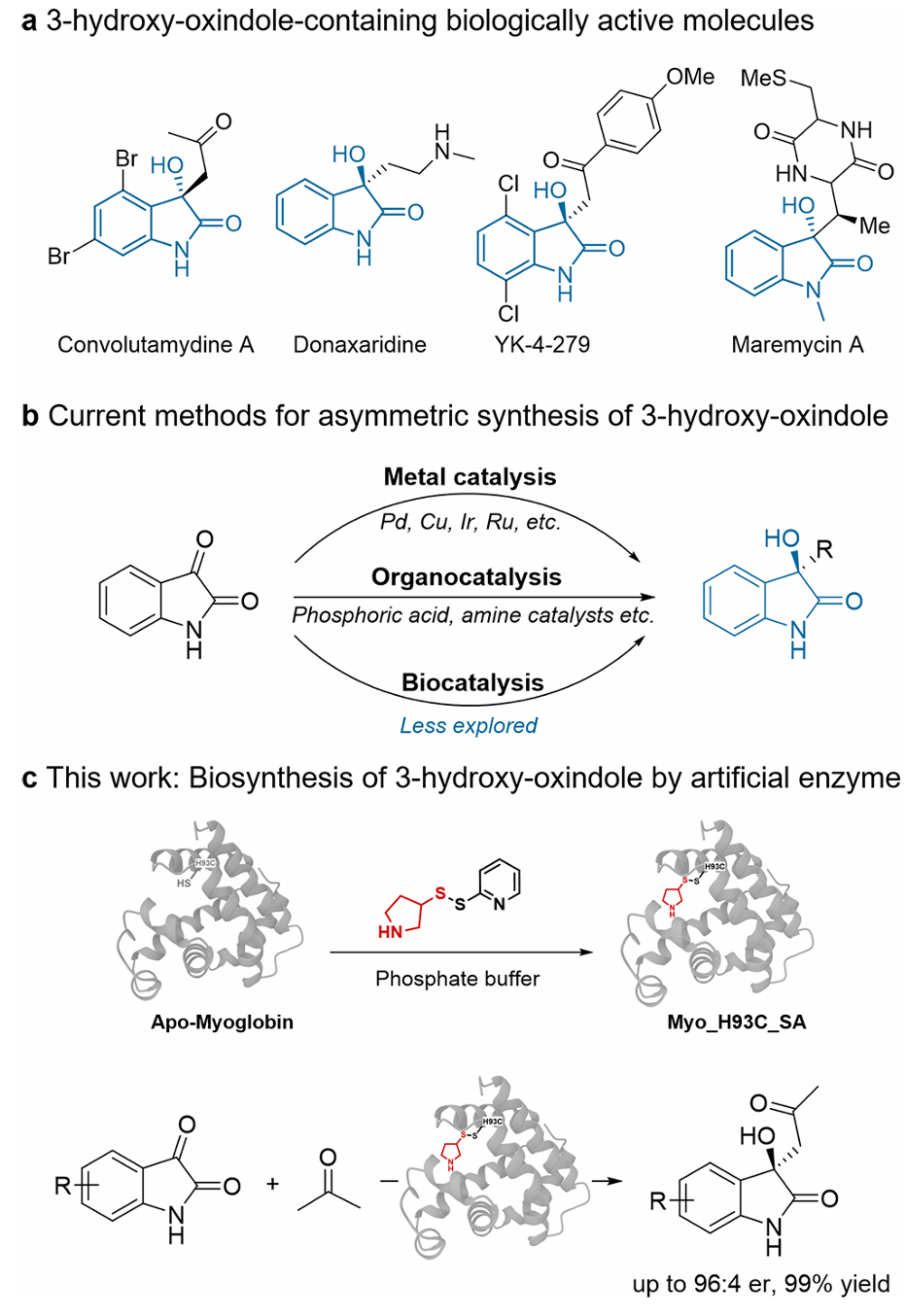
图1手性3-羟基氧化吲哚的合成
作者选择了丙酮与吲哚醌的缩醛反应作为本研究的模型反应。经共价酶库筛选,大部分人工酶显示出可检测的对映选择性和催化活性,其中,Apo-Myo_H93C_SA显示出最高的反应活性和手性,比例为75:25,产率高达98%。对照实验显示为未共价的Apo-Myo_H93C蛋白、单独的辅因子,以及Apo-Myo与辅因子的组合仅产生了适度的背景产率,但没有任何对映体选择性。
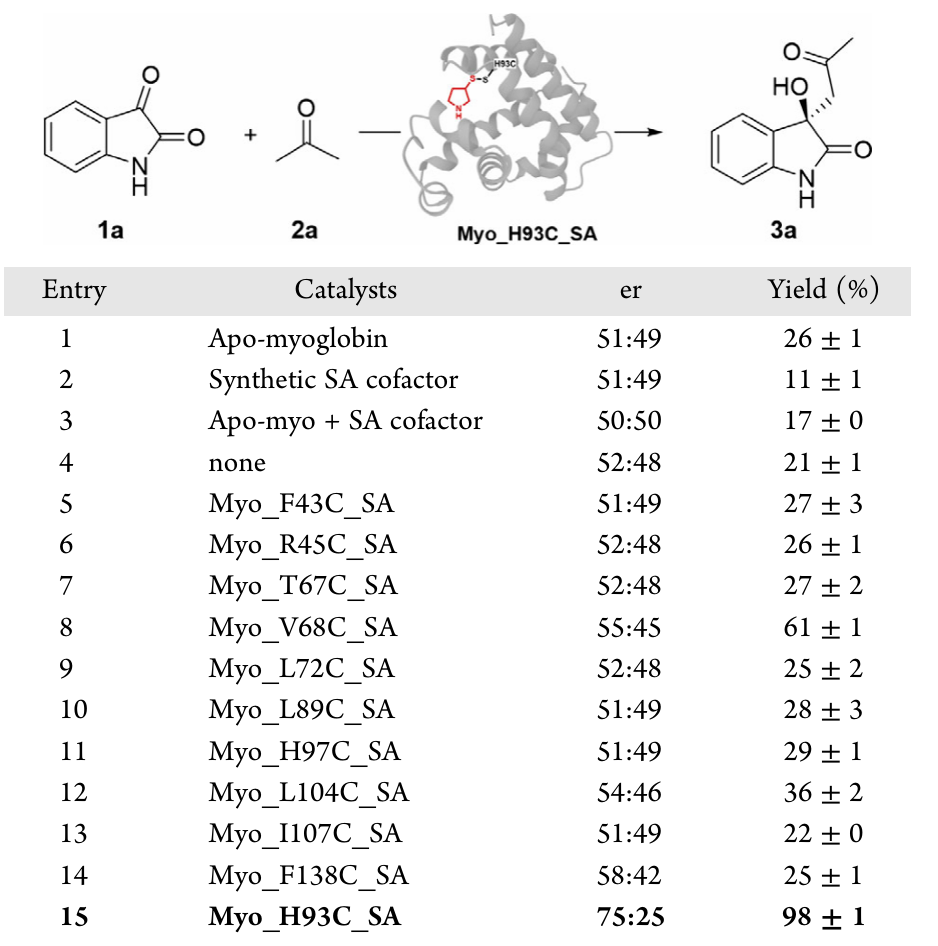
图2人工酶催化的不对称醛缩反应及其控制
基于初步筛选成果,团队开启定向进化以提升人工酶对模板反应的立体选择性。作者首先通过丙氨酸扫描法研究朝向腔体内且靠近残基93的共计14个氨基酸残基,进行丙氨酸突变实验评估这些位点在缩醛反应中的重要性。7个残基被选中用于后续定向进化,此后作者进行了两轮组合突变进化并优化反应参数,并确定M3_SA(Apo-Myo_H93C_F43A_T67R_SA)为最优突变体(对映选择性为96:4,产率98%)。
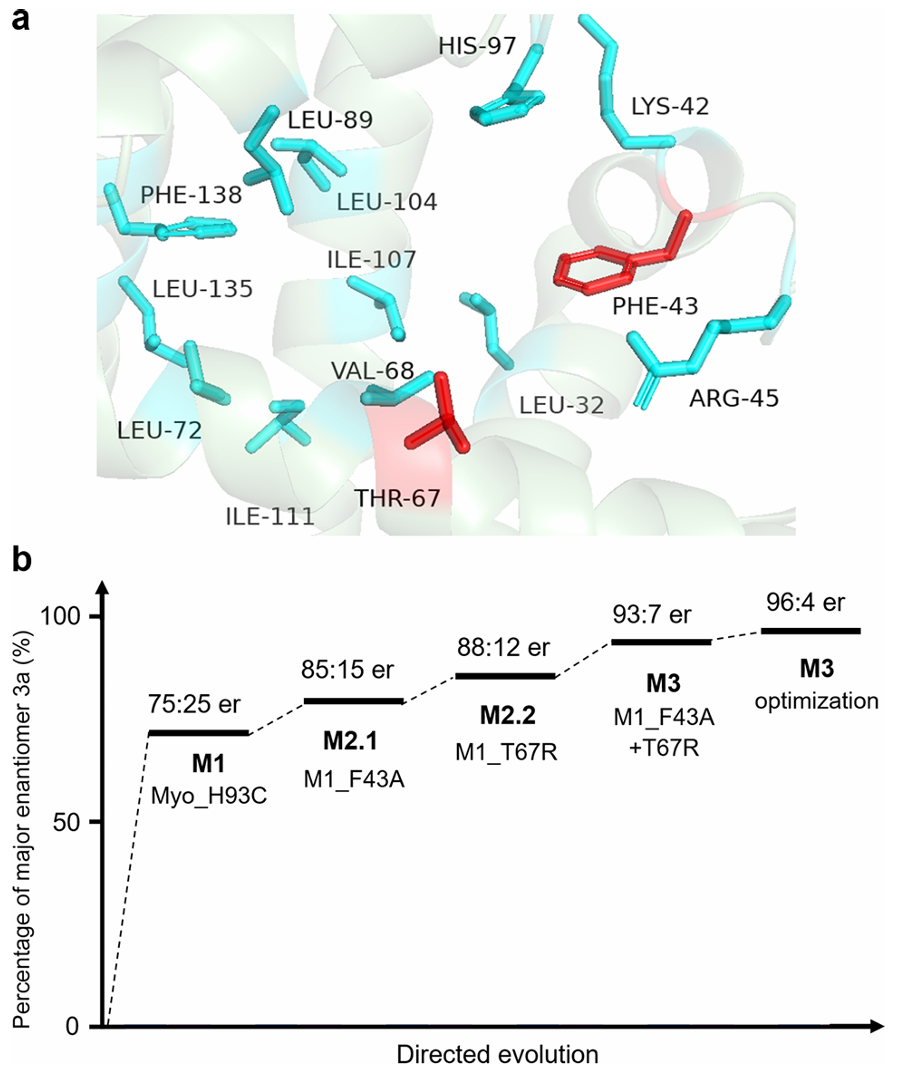
图3基于吲哚醌底物的人工醛缩酶的定向进化
团队后续基于最优突变体展开该反应的底物谱研究。结果显示,最优突变体M3_SA对多数底物均展现优异的对映选择性与产率。具有给电子基团甲氧基(3c)、吸电子基团卤素取代(3d-3g)的取代吲哚醌底物均能保持高对映选择性与反应活性。但得注意的是,吲哚氮上的氢原子的取代将导致明显降低的对映选择性,表明该氢原子可能对底物结合与催化过程至关重要。
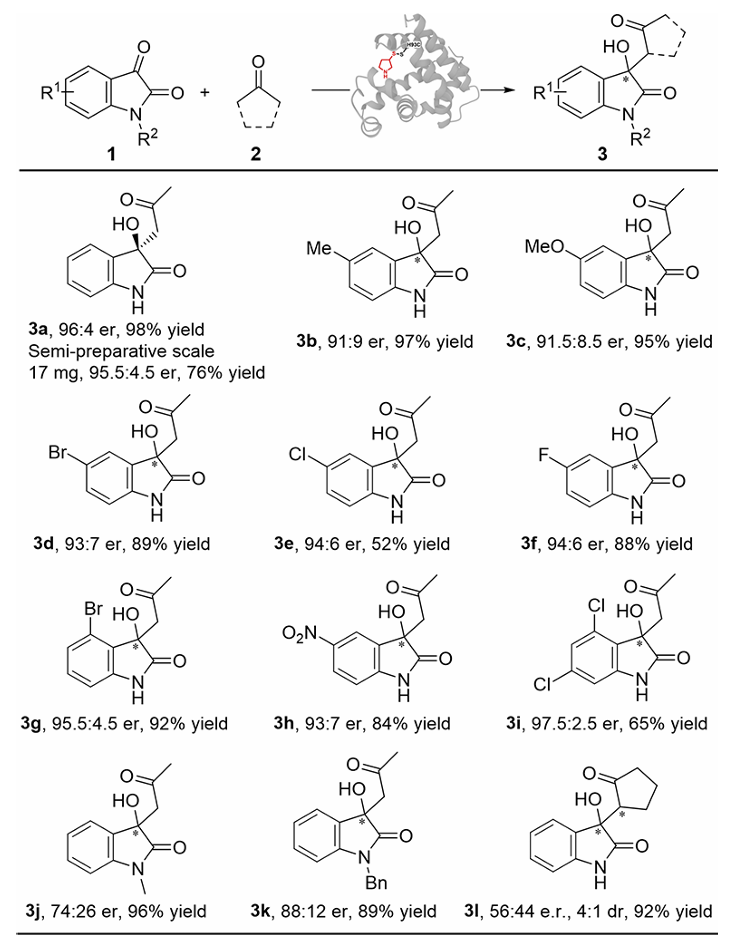
图4人工酶M3_SA催化的Aldol反应底物谱考察
此研究开发了一种高效的生物催化途径,通过在肌红蛋白骨架apo-Myo中嵌入非天然催化位点的人工醛缩酶,实现立体选择性的3-羟基氧化吲哚化合物的生物合成。该人工醛缩酶通过将肌红蛋白与人工辅因子共价修饰而高效构建。人工醛缩酶的定向进化使得能够以优异的立体选择性和反应性生产多样化的手性3-羟基氧化吲哚。该工作不仅将人工醛缩酶的催化能力扩展至对药物相关吲哚醌骨架进行不对称组装,还展示了一种将设计型小分子催化剂嵌入蛋白骨架的一般策略——这一方法有望加速将创新化学纳入生物催化流程,从而实现多样化药物相关结构的合成。
相关研究结果发表于在国际知名化学期刊《Organic Letters》上。第一作者为江南大学2022级硕士研究生凤良玉,通讯作者为江南大学周志教授与博士生朱致熹。工作得到了科技部重点研发计划、国家自然科学基金等项目的支持。
文章链接:https://doi.org/10.1021/acs.orglett.5c04724
周志教授课题组主页:
https://www.x-mol.com/groups/zhouzhi


